Noviembre 11 de 2018
Hola estudiantes a continuación relaciono las notas de química. Si encuentran inconformidad, con gusto los atenderé en un espacio de 3 minutos por estudiante, el próximo 14 de noviembre de 3:30 a 4:00 p.m.
Para efectos de nivelación de desempeños básicos o bajos se citan el próximo 21 de noviembre en horario de 3:00 a 4:00 p.m. Favor llevar el cuaderno y demás útiles escolares.
Lo mismo aplica a los estudiantes con desempeño bajo o básico en Biología.
Noviembre 7 de 2018
Estudiantes y Padres de familia mil gracias y un Dios se lo pague por toda la disposición, compromiso e interés demostrado a lo largo de este año escolar 2018.

Actividades de clase:
Acciones de Mejora:
__________________________________________________________________________________________________________________________________________________
Socialización del desempeño final.
Asignación de compromisos a estudiantes con desempeño bajo o básico.
Octubre 31 de 2018
Actividades de clase:
Octubre 24 de 2018
Actividades de clase:
Resolver actividades pendientes de la clase pasada.
Explicación de nomenclatura de alcanos ramificados, tipos de carbonos, alquenos y alquinos.
Imprimir las páginas del 1 al 6 del siguiente link.
http://depa.fquim.unam.mx/amyd/archivero/Organica_32396.pdf
Octubre 17 de 2018
Actividades de clase:
Evaluación del tema: Determinación cuantitativa del PH-POH. Favor estudiar.
Se continúa con las explicaciones del tema: Alcanos, nomenclatura de cadenas lineales y ramificadas.
Resolver las actividades propuestas en el siguiente link:
https://www.fullquimica.com/2012/09/ejercicios-de-alcanos-nivel-1.html

Hola estudiantes a continuación relaciono las notas de química. Si encuentran inconformidad, con gusto los atenderé en un espacio de 3 minutos por estudiante, el próximo 14 de noviembre de 3:30 a 4:00 p.m.
| AMADO MEJIA ANA VALENTINA | 4,755 |
| CARTAGENA ROJAS JHON ALEXANDER | 4,433333333 |
| BARRERO OLIVEIRA MARIA VICTORIA | 4,52 |
| MATIZ RODRIGUEZ NICOLE DAYANA | 3,808333333 |
| MEDINA GONZALEZ AURA LUCIA | 4,753333333 |
| MORALES FAYAD ANA ZHARIHE | 3,745 |
| NAVARRO RAMIREZ JUAN JOSE | 4,231666667 |
| REYES ANA SOFIA | 4,52 |
| RODRIGUEZ ROY SANTIAGO | 2,9 |
| TELLO FONSECA MARIA ALEJANDRA | 3,066666667 |
Para efectos de nivelación de desempeños básicos o bajos se citan el próximo 21 de noviembre en horario de 3:00 a 4:00 p.m. Favor llevar el cuaderno y demás útiles escolares.
Lo mismo aplica a los estudiantes con desempeño bajo o básico en Biología.
Noviembre 7 de 2018
Estudiantes y Padres de familia mil gracias y un Dios se lo pague por toda la disposición, compromiso e interés demostrado a lo largo de este año escolar 2018.

Actividades de clase:
Calificación de la dimensión Formativa: Favor traer organizado en el cuaderno la siguiente tabla:
VALORACIÓN DIMENSIÓN FORMATIVA
CRITERIO
|
AUTO
EVALUACIÓN
|
COE
VALUACION
|
HETERO
EVALUACION
| |
1
|
Busco la excelencia en el desarrollo y presentación de tareas y trabajos.
| |||
2
|
Presento buena disposición en clase, soy atento y participativo.
| |||
3
|
Mantengo buena disciplina durante toda la clase.
| |||
4
|
Acato las normas de presentación personal establecidas por la Institución.
| |||
5
|
Cumplo oportunamente con las actividades extra clase.
| |||
TOTAL
|
Acciones de Mejora:
__________________________________________________________________________________________________________________________________________________
Acciones Correctivas:
__________________________________________________________________________________________________________________________________________________
__________________________________________________________________________________________________________________________________________________
Acciones Preventiva:
__________________________________________________________________________________________________________________________________________________
Revisión de actividades pendientes.
Continuar con las actividades pendientes.
Evaluación de los temas vistos: Nomenclatura de Alcanos lineal y ramificados. Favor estudiar.
Asignación de compromisos a estudiantes con desempeño bajo o básico.
Octubre 31 de 2018
Actividades de clase:
Continuar con las actividades pendientes.
Evaluación de los temas vistos: Nomenclatura de Alcanos lineal y ramificados. Favor estudiar.
Octubre 24 de 2018
Actividades de clase:
Resolver actividades pendientes de la clase pasada.
Explicación de nomenclatura de alcanos ramificados, tipos de carbonos, alquenos y alquinos.
Imprimir las páginas del 1 al 6 del siguiente link.
http://depa.fquim.unam.mx/amyd/archivero/Organica_32396.pdf
Octubre 17 de 2018
Actividades de clase:
Evaluación del tema: Determinación cuantitativa del PH-POH. Favor estudiar.
Se continúa con las explicaciones del tema: Alcanos, nomenclatura de cadenas lineales y ramificadas.
Resolver las actividades propuestas en el siguiente link:
https://www.fullquimica.com/2012/09/ejercicios-de-alcanos-nivel-1.html
Saturar las siguientes cadenas:
2° Completa la siguiente información:
Ejercicio
|
Fórmula Desarrollada condensada
|
Fórmula Molecular
|
Fórmula esquelética
|
a
| |||
b
| |||
c
| |||
d
| |||
e
| |||
f
|
Octubre 10 de 2018
Octubre 3 de 2018
Actividades de clase:
Revisión y calificación de la actividad extra clase.
Evaluación escrita de PH-POH. Favor estudiar.
Explicación del tema: Cálculos estequiométricos. Desarrollo del taller propuesto por la docente en clase.
Septiembre 26 de 2018
PROBLEMAS DE pH y pOH
1.- Calcular el pH del H2 del agua, si su concentración de iones H+ es igual a 1X107mol/L.
2.- Calcular el pH de una solución de HCl, si su concentración de iones H+ es igual a 0.0045 N.
3.- Calcular el pOH del NaOH, si su concentración de iones OH- es igual a 0.002 N.
4.- Calcúlese el pH de cada una de las siguientes soluciones:
a) Ácido clorhídrico, HCl = 0.0045 M .
b) Hidróxido de sodio, NaOH = 0.050 M .
c) Ácido sulfúrico, H2SO4 = 0.00012 M .
d) Hidróxido de potasio, KOH = 0.0069 M .
5.- Calcúlese el pOH de las siguientes soluciones:
a) HCl = 0.0010 M .
b) NaOH = 0.0010 M .
c) HNO3 = 0.0050 M .
d) Ba(OH)2 = 0.0050 M .
6.- Calcular el pOH y el pH de una solución 0.0018 M de Al(OH)3.
7.- Calcular el pH y el pOH de una solución de CH3COOH 4.9X10-4 M .
8.- Calcula el pH y el pOH de una solución cuya concentración de iones hidronio es 2.3X10-4 mol/L de HNO3.
9.- Calcular el pH y el pOH de una solución de H3PO4 3.6X10-3 M .
10.- Calcular el pOH del Ca(OH)2, si su concentración de iones OH- es igual a 0.0003 M .
11.- Se midió el pH de la orina de Leonardo DiCaprio, actor británico, éste fue de 5.4. Determina la concentración de iones hidrógeno de la orina.
12.- El “gatorade”, una bebida popular para calmar la sed, tiene una concentración de ión hidrógeno de 8X10-4 mol/L. Calcula su pH y pOH.
13.- Si una solución acuosa de HNO3 tiene una concentración de 0.04 M . ¿Cuál será su pH?
14.- Una solución acuosa tiene una concentración de 0.003 M de H2CO3. Determina el pH y el pOH.
Organizados en grupos de dos estudiantes resolver las siguientes actividades, apoyados con material entregado por la docente en clase. Exposición de:
Ácidos y bases:
Concepto experimental
Concepto de Arrhenius
Concepto de Bronsted y Lowry
Concepto de Lewis
Favor llevar pliegos de papel periódico, marcadores y regla.
Septiembre 19 de 2018
Iniciamos................
Actividades de clase:
Favor copiar en el cuaderno o imprimir y pegar en el cuaderno.
GIMNASIO PEDAGÓGICO NOVA ESTRELLA
III Periodo
Química
Grado Noveno
Competencias:
Compara algunas teorías (Arrhenius, Brönsted – Lowry y Lewis) que explican el comportamiento químico de los ácidos y las bases para interpretar las propiedades ácidas o básicas de algunos compuestos.
Resuelve problemas aplicando cálculos estequiométricos en la formación de productos.
Realiza reacciones químicas haciendo uso de la estequiometria.
Identificar el reactivo límite en una reacción
química mediante la aplicación de cálculos.
Obtener
productos identificando reactivo límite, aplicando cálculos matemáticos.
Conocimientos:
RELACIONES
ESTEQUIOMÉTRICAS EN LAS REACCIONES QUÍMICAS
Cálculos
masa-masa
Cálculos
mol-mol
Cálculos
mol-masa
RENDIMIENTO
Y PUREZA
Reactivo Límite
Eficiencia
Pureza
Orientador
Lic. Astrid Cardoso Contreras
Para que nuestros estudiantes, brillen por la inteligencia de su mente y de su corazón
Continuaremos resolviendo el taller pendiente sobre determinación cuantitativa del POH.
Organizados en grupos de dos estudiantes resolver las siguientes actividades, apoyados con material entregado por la docente en clase. Exposición de:
Ácidos y bases:
Concepto experimental
Concepto de Arrhenius
Concepto de Bronsted y Lowry
Concepto de Lewis
Favor llevar pliegos de papel periódico, marcadores y regla.
Septiembre 12 de 2018
Actividades de Clase:
A continuación relaciono las notas finales del tercer período, faltando por registrar la autoevaluación, coevaluación y heteroevaluación:
| AMADO MEJIA ANA VALENTINA | 4,93666667 |
| CARTAGENA ROJAS JHON ALEXANDER | 4,76111111 |
| BARRERO OLIVEIRA MARIA VICTORIA | 4,57666667 |
| MATIZ RODRIGUEZ NICOLE DAYANA | 3,7 |
| MEDINA GONZALEZ AURA LUCIA | 4 |
| MORALES FAYAD ANA ZHARIHE | 3,65333333 |
| NAVARRO RAMIREZ JUAN JOSE | 3,69111111 |
| REYES ANA SOFIA | 4,90333333 |
| RODRIGUEZ ROY SANTIAGO | 4,1 |
| TELLO FONSECA MARIA ALEJANDRA | 3,86666667 |
Los estudiantes con desempeño básico favor proponer 10 ejercicio sobre:
Nomenclatura de óxidos
Formulación de óxidos
Nomenclatura de Hidróxidos
Formulación de Hidróxidos
Nomenclatura de ácidos
Formulación de ácidos
Nomenclatura de sales
Formulación de sales
Estudiar para sustentación escrita del mismo trabajo.
Sin embargo en clase se socializarán de nuevo estas notas y se hará la calificación de la dimensión Formativa: Favor traer organizado en el cuaderno la siguiente tabla:
VALORACION DIMENSION FORMATIVA
CRITERIO
|
AUTO
EVALUACION
|
COE
VALUACION
|
HETERO
EVALUACION
| |
1
|
Busco la excelencia en el desarrollo y presentación de tareas y trabajos.
| |||
2
|
Presento buena disposición en clase, soy atento y participativo.
| |||
3
|
Mantengo buena disciplina durante toda la clase.
| |||
4
|
Acato las normas de presentación personal establecidas por la Institución.
| |||
5
|
Cumplo oportunamente con las actividades extra clase.
| |||
TOTAL
|
Acciones de Mejora:
__________________________________________________________________________________________________________________________________________________
Acciones Correctivas:
__________________________________________________________________________________________________________________________________________________
__________________________________________________________________________________________________________________________________________________
Acciones Preventiva:
__________________________________________________________________________________________________________________________________________________
Septiembre 3 de 2018
Muy bien muchachos. El trabajo realizado en la Segunda Feria de la Ciencia fue de mi total agrado.
Actividades de clase:
Evaluación del tema Nomenclatura Mineral. Favor estudiar.
Continuamos con las actividades pendientes de la clase del 22 de agosto. Favor revisar.
Agosto 29 de 2018
HOLA CHIC@S:
En esta fecha se celebrará el día de la ciencia, en las horas de la tarde.
Por lo anterior informo los siguientes aspectos:
Es necesario llevar la bata de laboratorio.
Por código de lista se asignan las siguientes actividades que serán revisadas el 27 de agosto en horario de 3:00 a 4:00 p.m, para verificar si lo han hecho como se espera.
Cada estudiante debe organizar con mucha creatividad y estética el stand. Cada stand debe tener su cartelera con el nombre asignado.
El 29 de septiembre se citan a las 2:00 p.m para llegar a organizar su stand y empezar a las 2:30 para exponer tanto a sus compañeros como estudiantes invitados el tema o actividad asignada por código de lista.
Las actividades se dividen en dos momentos:
De 2:30 a 3:30 Exposición del tema o actividad asignada
De 4:00 a 5:30: Actividad didáctica (juegos) según tema asignado. Favor llevar dulces para regalar a los concursantes.
Se aclara que se han organizado en grupos de dos estudiantes para que se repartan las actividades y cumplan con los compromisos asignados.
Las actividades didácticas del segundo momento (4:00 a 5:30) según código de lista:
Código 2 y 8:
Barrero María Victoria y Reyes Ana Sofía
Juguemos con la Nomenclatura Mineral:
Dibujar en cartelera gigante la Pata sola (golosa) y pegarla al piso, para jugar respondiendo a preguntas como: Cuál es el fórmula del ácido nítrico? Si aciertan pueden lanzar el dado y avanzar en la pata sola.Favor llevar dulces para dar como premio.
Códigos 1 y 4:
Amado Ana Valentina y Matiz Nicole
Juguemos con la Nomenclatura Mineral:
Dibujar en cartelera gigante el juego la escalera y pegarla al piso, para jugar respondiendo a preguntas como: Cúal es la fórmula general de los óxidos? Si aciertan pueden lanzar el dado y avanzar en la pata sola.Favor llevar dulces para dar como premio.
Códigos 3 y 5:
Cartagena Jhon y Medina Aura Lucía
Juguemos con la Nomenclatura Mineral:
Dibujar en cartelera gigante el juego TWISTER y pegarla al piso, para jugar respondiendo a preguntas como: Cuáles son los números de oxidación del Cloro? Si aciertan pueden lanzar el dado y avanzar en la pata sola.Favor llevar dulces para dar como premio.
Códigos 7 y 9:
Navarro Juan José y Rodriguez Roy Santiago
Juguemos con la Nomenclatura Mineral:Dibujar en cartelera gigante el juego parqués y pegarla al piso, para jugar respondiendo a preguntas como: Cuál es el grupo funcional de los hidróxidos? Si aciertan pueden lanzar el dado y avanzar en la pata sola.Favor llevar dulces para dar como premio.
Códigos 6 y 10:
Morales Ana y Tello Alejandra
Juguemos con la Nomenclatura Mineral:
Jugar yenga, domino, entre otros, respondiendo a preguntas como: Cuál es el grupo funcional de los hidróxidos? Si aciertan pueden lanzar el dado y avanzar en la pata sola.Favor llevar dulces para dar como premio.
Jugar yenga, domino, entre otros, respondiendo a preguntas como: Cuál es el grupo funcional de los hidróxidos? Si aciertan pueden lanzar el dado y avanzar en la pata sola.Favor llevar dulces para dar como premio.
Agosto 22 de 2018
Actividades de clase:
Evaluación final del tema: Nomenclatura Mineral.Favor estudiar.
Explicación del tema: Determinación cuantitativa del PH
Ejercicios
Determinar el pH y pOH de las siguientes disoluciones consideradas como electrolitos fuertes:
a) HCl
|
b) HNO32,7·10-
|
c) HBr 7,9·10-
|
d) H2SO44·10-
|
e) HI 7,2·10-
|
f) NaOH 4,7·10-
|
g) KOH 9,4·10-
|
h) Ba(OH)22,5·10-
|
i) LiOH 3,6·10-
|
j) NaOH 4,2·10-
|
Solución en: http://cpa-quimica.blogspot.com/
PROBLEMAS DE pH y pOH
1.- Calcular el pH del H2 del agua, si su concentración de iones H+ es igual a 1X107mol/L.
2.- Calcular el pH de una solución de HCl, si su concentración de iones H+ es igual a 0.0045 N.
3.- Calcular el pOH del NaOH, si su concentración de iones OH- es igual a 0.002 N.
4.- Calcúlese el pH de cada una de las siguientes soluciones:
a) Ácido clorhídrico, HCl = 0.0045 M .
b) Hidróxido de sodio, NaOH = 0.050 M .
c) Ácido sulfúrico, H2SO4 = 0.00012 M .
d) Hidróxido de potasio, KOH = 0.0069 M .
5.- Calcúlese el pOH de las siguientes soluciones:
a) HCl = 0.0010 M .
b) NaOH = 0.0010 M .
c) HNO3 = 0.0050 M .
d) Ba(OH)2 = 0.0050 M .
6.- Calcular el pOH y el pH de una solución 0.0018 M de Al(OH)3.
7.- Calcular el pH y el pOH de una solución de CH3COOH 4.9X10-4 M .
8.- Calcula el pH y el pOH de una solución cuya concentración de iones hidronio es 2.3X10-4 mol/L de HNO3.
9.- Calcular el pH y el pOH de una solución de H3PO4 3.6X10-3 M .
10.- Calcular el pOH del Ca(OH)2, si su concentración de iones OH- es igual a 0.0003 M .
11.- Se midió el pH de la orina de Leonardo DiCaprio, actor británico, éste fue de 5.4. Determina la concentración de iones hidrógeno de la orina.
12.- El “gatorade”, una bebida popular para calmar la sed, tiene una concentración de ión hidrógeno de 8X10-4 mol/L. Calcula su pH y pOH.
13.- Si una solución acuosa de HNO3 tiene una concentración de 0.04 M . ¿Cuál será su pH?
14.- Una solución acuosa tiene una concentración de 0.003 M de H2CO3. Determina el pH y el pOH.
Agosto 15 de 2018
Actividades de clase:
Continuar resolviendo actividades pendientes de la semana pasada.
Favor reforzar el tema de nomenclatura, ya que será evaluado en clase pasando a resolver ejercicios en el tablero.
Se evaluará los grupos A de la tabla periódica. Favor repasarlos.
Agosto 8 de 2018
Actividades de clase:
Continuar resolviendo actividades pendientes de la semana pasada.
Favor reforzar el tema de nomenclatura, ya que será evaluado en clase pasando a resolver ejercicios en el tablero.
Agosto 1 de 2018
Luego de observar el trabajo de pre saberes observo con preocupación que estamos avanzado a pasos agigantados, sin embargo no logré evidenciar estos conocimientos básicos que se debe tener para comprender los temas del tercer período, por lo tanto los invito a asumir con más compromiso estos aprendizajes.
Por lo anterior se continuará reforzando los pre saberes en nomenclatura mineral.
La actividad del protocolo solicitado desde la segunda semana de julio se aplaza hasta nueva fecha.
ACTIVIDADES DE CLASE:
Retroalimentación del tema: Funciones de la química Mineral
1. ¿Cómo se forma un Óxido?
2. Escriba la ecuación de formación de un óxido.
3. ¿Qué es un óxido básico?
4. Escriba la fórmula de 5 óxidos básicos.
5. ¿Qué es un óxido ácido?
6. Escriba la fórmula de 5 óxidos ácidos.
7. ¿Cómo se forma un Hidróxido?
8. Cuál es el grupo funcional de las bases?
9. Escriba la ecuación de formación de un Hidróxido.
10. ¿Qué es un ácido?
11. Cuál es la fórmula general de los ácidos hidrácidos y de los oxácidos
12. Cuál es el grupo funcional de los ácidos?
13. Escriba la fórmula general de las sales haloideas y oxisal.
14. Escriba la ecuación para la formación de sales haloideas y oxisal
Resolver el siguiente taller:
Dé el nombre a los siguientes hidróxidos en los 3 sistemas de nomenclatura estudiados en clase.
a. Fe(OH)3
b. Cu(OH)2
c. Mg(OH)2
d. Cr(OH)6
e. KOH
f. Pt(OH)4
Escriba la fórmula de los siguiente compuestos:
a. Óxido de litio.
b. Hidróxido áurico.
c. Hidróxido de bario.
d. Óxido de plomo (IV).
e. Hidróxido de cobre (II).
f. Óxido nitroso.
Complete y balancee las siguientes ecuaciones químicas:
a. Al2O3 + ? H2O →
b. BaO + ? H2O →
c. PbO2 + ? H2O →
d. Cu2O + ? H2O →
Complete las siguientes ecuaciones con el nombre del hidróxido formado:
a. Oxido ferroso + agua →
b. Oxido de aluminio + agua →
c. Trióxido de azufre + agua →
d. Oxido estánico + agua →
- Escribe la valencia de cada uno de los elementos en los siguientes compuestos:
- HFO
- HClO
- HBrO
- HIO
- HClO2
- H2SO2
- HNO2
- H2CO3
- H2SO3
- HIO3
- Nombra los compuestos siguientes:
- HFO
- HClO2
- HBrO3
- HIO4
- H2SO2
- HNO3
- H2CO3
- H3PO4
- Escribe la fórmula química de los siguientes compuestos:
- Ácido selénico
- Ácido perfluórico
- Ácido clórico
- Ácido bromoso
- Ácido hipoyodoso
- Ácido sulfúrico
- Ácido nitroso
- Ácido carbónico
- Ácido fosfórico
Explicar el tema de sales y resolver el siguiente taller:
HClO3
|
H2SO4
|
H3PO3
|
HIO4
|
HBr
|
H2CO2
|
HNO3
|
HClO2
| |
NaOH
| ||||||||
Ca(OH)2
| ||||||||
Fe(OH)3
| ||||||||
Ni(OH)2
| ||||||||
Bi(OH)5
| ||||||||
CuOH
| ||||||||
Au(OH)3
| ||||||||
Pb(OH)2
| ||||||||
Mg(OH)2
| ||||||||
Sn(OH)4
|
- Escribe la valencia de cada uno de los elementos en los siguientes compuestos:
- HFO
- HClO
- HBrO
- HIO
- HClO2
- H2SO2
- HNO2
- H2CO3
- H2SO3
- HIO3
- Nombra los compuestos siguientes:
- HFO
- HClO2
- HBrO3
- HIO4
- H2SO2
- HNO3
- H2CO3
- H3PO4
- Nombra los siguientes ácidos:
- HBrO
- HBrO2
- HBrO3
- HBrO4
- HIO
- HIO2
- HIO3
- HIO4
- HNO2
- H2SeO2
- H2SO3
- H2TeO2
- H2SO4
- H2TeO3
- H2TeO4
- HClO
- HClO2
- HClO3
- HClO4
- Escribe la fórmula química de los siguientes compuestos:
- Ácido selénico
- Ácido perfluórico
- Ácido clórico
- Ácido bromoso
- Ácido hipoyodoso
- Ácido sulfúrico
- Ácido nitroso
- Ácido carbónico
- Ácido fosfórico
- Ácido yodico
- Ácido nítrico
- Ácido selénico
- Ácido sulfúrico
- Ácido telúrico
- Ácido cloroso
- Ácido perclórico
- Ácido hipocloroso
- Ácido clórico
Julio 25 de 2018
ACTIVIDADES DE CLASE:
Se desarrollarán las programadas para la clase del 18 de julio.
Julio 18 de 2018
LAS CLASES CONTINÚAN EN SU HORARIO HABITUAL, ES DECIR LOS MIÉRCOLES. LISTO.
ACTIVIDADES DE CLASE:
Desarrollo de las actividades pendiente de la clase pasada.
No olvidar repasar el tema de Nomenclatura Mineral, ya que aplicaré una prueba de pre saberes y espero encontrar buenos resultados.
Julio 11 de 2018
Hola chic@s los saludo con un fuerte abrazo y con los mejores deseos para iniciar con ganas el segundo semestre.
Ya descansamos lo necesario y de nuevo debemos estudiar con amor, dedicación y alegría.
A continuación relaciono las actividades de clase:
ACTIVIDADES DE CLASE:
Favor escribir en el cuaderno la competencia, contenidos temáticos y pregunta problematizadora del tercer período.
GIMNASIO PEDAGÓGICO NOVA ESTRELLA
III Periodo
Química
Grado Noveno
Competencias:
Determina la acidez y la basicidad de
compuestos dados, de manera cualitativa (colorimetría) y cuantitativa (escala
de pH - pOH).
Explica la función de los ácidos y las bases
en procesos propios de los seres vivos (respiración y digestión en el estómago)
y de procesos industriales (uso fertilizantes en la agricultura) y limpieza (jabón).
Comprende
que la acidez y la basicidad son propiedades químicas de algunas sustancias y
las relaciona con su importancia biológica y su uso cotidiano e industrial.
Compara
algunas teorías (Arrhenius, Brönsted – Lowry y Lewis) que explican el
comportamiento químico de los ácidos y las bases para interpretar las
propiedades ácidas o básicas de algunos compuestos.
Conocimientos:
ACIDEZ Y BASICIDAD
Orientador
Lic. Astrid Cardoso Contreras
Para que nuestros estudiantes, brillen por la inteligencia de su mente y de su corazón
Evaluación de la Pregunta Problematizadora:
Cómo reconozco la concentración de las soluciones que uso a diario y cuál es su importancia?
PREGUNTA DE INDUCCIÓN Y RECONOCIMIENTO DE PRE SABERES:
A partir de la información contenida en las etiquetas de los productos que contengan soluciones explica sus componentes (soluto-solvente) y calcula su concentración. Elabora preguntas y predice posibles respuestas con base en argumentos de tipo teórico y experimental en las cuales se realicen variaciones de cantidad de soluto – solvente o se someta la muestra a la acción de la temperatura u otras variaciones que considere necesarias.
Cuál es la importancia del estudio del PH? Explicalo en máximo 10 renglones y mínimo 6.
Apóyate en la siguiente imagen.

Observa cada una de las siguientes imágenes y resuelve lo solicitado a continuación:
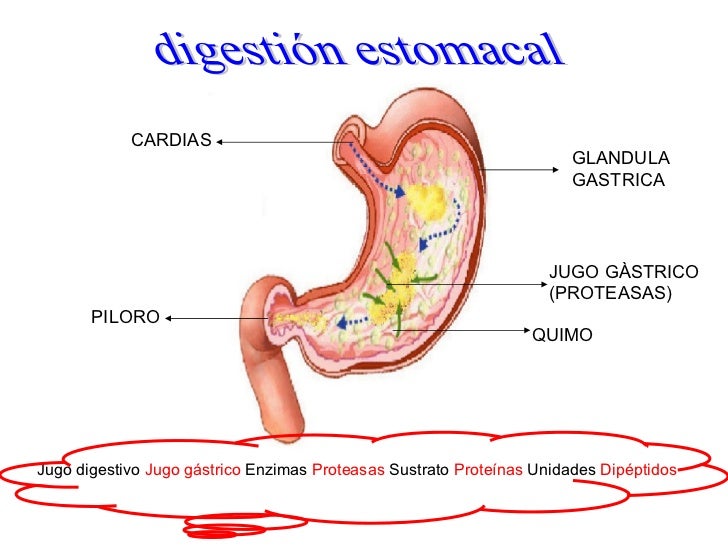
Figura-Proceso
|
Nombre de reactivos
|
Fórmula de reactivos
|
Nombre de productos
|
Fórmula de productos
|
Ecuación química
|
A
| |||||
B
| |||||
C
| |||||
D
| |||||
E
| |||||
F
|
Retroalimentación del tema: Funciones de la química Mineral
1. ¿Cómo se forma un Óxido?
2. Escriba la ecuación de formación de un óxido.
3. ¿Qué es un óxido básico?
4. Escriba la fórmula de 5 óxidos básicos.
5. ¿Qué es un óxido ácido?
6. Escriba la fórmula de 5 óxidos ácidos.
7. ¿Cómo se forma un Hidróxido?
8. Cuál es el grupo funcional de las bases?
9. Escriba la ecuación de formación de un Hidróxido.
10. ¿Qué es un ácido?
11. Cuál es la fórmula general de los ácidos hidrácidos y de los oxácidos
12. Cuál es el grupo funcional de los ácidos?
13. Escriba la fórmula general de las sales haloideas y oxisal.
14. Escriba la ecuación para la formación de sales haloideas y oxisal
ACTIVIDAD EXTRA CLASE: 25 de julio
Diseña protocolos experimentales en los cuales utiliza un conjunto de sustancias para clasificar materiales como ácidos o bases y determina sus niveles de acidez y basicidad. Para ello utiliza pH-metro, papel indicador o indicadores naturales y recursos tales como (vinagre, jabón, limón, detergente, plástico, vidrio, clavos) realizando los procedimientos (disoluciones, mezclas) que considere adecuados según el propósito y evaluando el nivel de precisión de los indicadores utilizados.
Durante el proceso formula conclusiones y proyecta lo que podría pasar al aplicar el protocolo a nuevas sustancias.
Reconoce además, algunos límites y variables que intervienen en las conclusiones que elabora.
Mayo 30 de 2018
ACTIVIDADES DE CLASE:
Evaluación final de período. Favor estudiar los temas vistos: Unidades físicas y químicas de concentración de las soluciones.
Revisión de la actividad extraclase: Terminar de resolver los ejercicios iniciados en la clase del 30 de mayo.
Evaluación de la dimensión formativa. Favor traer diligenciada la autoevaluación y organizado el formato en el cuaderno:
CRITERIO
|
AUTO
EVALUACION
|
COE
VALUACION
|
HETERO
EVALUACION
| |
1
|
Busco la excelencia en el desarrollo y presentación de tareas y trabajos.
| |||
2
|
Presento buena disposición en clase, soy atento y participativo.
| |||
3
|
Mantengo buena disciplina durante toda la clase.
| |||
4
|
Acato las normas de presentación personal establecidas por la Institución.
| |||
5
|
Cumplo oportunamente con las actividades extra clase.
| |||
TOTAL
|
Acciones de Mejora:
__________________________________________________________________________________________________________________________________________________
Acciones Correctivas:
__________________________________________________________________________________________________________________________________________________
__________________________________________________________________________________________________________________________________________________
Acciones Preventiva:
__________________________________________________________________________________________________________________________________________________
Los siguientes estudiantes llevan a la fecha un buen desempeño en la materia de Biología. FELICITACIONES.
AMADO MEJIA
ANA VALENTINA 4,5
BARRERO OLIVEIRA
MARIA VICTORIA 4,8
CARTAGENA ROJAS
JHON ALEXANDER 4,6
MEDINA GONZALEZ
AURA LUCIA 4,6
MORALES
FAYAD ANA ZHARIHE 4,2
REYES ANA
SOFIA 4,9
TELLO FONSECA
MARIA ALEJANDRA 4,0
A continuación se relacionan los estudiantes que presentan desempeño Básico, con las actividades sugeridas para mejorar el desempeño. Estas se calificaran en la clase del 13 de junio:
Presentar el cuaderno al día con todas las actividades del período:
MATIZ RODRIGUEZ NICOLE DAYANA 3,9
RODRIGUEZ ROY SANTIAGO 3,5
A continuación se relacionan los estudiantes que a la fecha presentan desempeño
bajo, por lo que se les recomienda realizar las actividades de recuperación que se proponen en seguida, para ser presentados y sustentados en forma escrita en la clase del 13 de junio:
Crucigrama con 20 términos estudiados en el período, presentado en una cartelera.
Sopa de letras con 20 términos estudiados en el período, estudiando sus definiciones. Presentado en cartelera.
Proponer 10 ejemplos de cada reacción química y 10 ejemplos de ecuaciones balanceadas por tanteo.
NAVARRO RAMIREZ JUAN JOSE 3,2
Junio 6 de 2018
No se programan actividades por cambio de horario
Mayo 30 de 2018
ACTIVIDADES DE CLASE:
http://bdigital.unal.edu.co/52807/12/1067836869.2016.resultadoproyectodeaula.pdf
y copie en el cuaderno las páginas 6, 10, 11 y 12
y traer en grupos de tres estudiantes pequeñas cantidades de:
Aceite de cocina - Sal de cocina (NaCl) - Agua - Glicerina - Alcohol etílico - Jeringas de 5 ml - Vasos desechables pequeños
Mayo 23 de 2018
ACTIVIDADES DE CLASE:
Evaluación de símbolos y nombres de los 8 grupos A de la tabla periódica.
Taller sobre molalidad y normalidad, propuesto por la docente en clase.
No se programan actividades por compensatorio del día del profesor. Gracias Directivas.
Mayo 9 de 2018
ACTIVIDADES DE CLASE:
Evaluación de símbolos y nombres de los 8 grupos A de la tabla periódica.
Taller sobre molalidad y normalidad, propuesto por la docente en clase.
ACTIVIDADES EXTRA CLASE:
Terminar desde casa el taller del siguiente link, iniciado en la clase pasada:
http://quimicageneralpapimeunam.org.mx/materiasQFBacceso_archivos/QUIMICA_GENERAL%20I/ALGUNOS_EXAMENES/1aPARTE_EXAMEN_NOMENCLATURA.htm
ACTIVIDADES DE CLASE:
Imprimir la actividad propuesta en el siguiente link, ya que la utilizaremos en clase como evaluación de repaso sobre nomenclatura de hidróxidos, ácidos y sales:
http://quimicageneralpapimeunam.org.mx/materiasQFBacceso_archivos/QUIMICA_GENERAL%20I/ALGUNOS_EXAMENES/1aPARTE_EXAMEN_NOMENCLATURA.htm
Continuar con la explicación del tema: Molalidad y Normalidad.
Desarrollo de ejercicios propuestos por la docente
Favor llevar calculadora y Tabla Periódica.
ACTIVIDAD EXTRA CLASE: Para resolver desde casa:
Favor ingresar al siguiente link y resolver la actividad allí propuesta, registrando en el cuaderno los respectivos pantallazos de las respuestas dadas a cada pregunta y el puntaje total alncanzado
https://es.educaplay.com/es/recursoseducativos/1389056/oxidos_hidroxidos_y_sales.htmAbril 25 de 2018
ACTIVIDADES DE CLASE:
Evaluación de la pregunta problematizadora del primer período. Favor prepararse al respecto.
Explicación del tema: Molalidad y Normalidad.
Desarrollo de ejercicios propuestos por la docente
ACTIVIDADES DE CLASE:
Favor escribir en el cuaderno la competencia, contenidos temáticos y pregunta problematizadora del segundo período.
GIMNASIO PEDAGÓGICO NOVA ESTRELLA
II Periodo
Química
Grado Noveno
Competencias:
Resuelve
problemas relacionados con soluciones con la aplicación de fórmulas.
Identifica
soluciones diluidas de concentradas en forma experimental.
Asumo los valores de: responsabilidad, equidad, tolerancia y respeto dentro y fuera del aula.
Conocimientos:
Unidades Químicas de Concentración de las soluciones
Orientador
Lic. Astrid Cardoso Contreras
Para que nuestros estudiantes, brillen por la inteligencia de su mente y de su corazón
Pregunta Problematizadora:
Cómo reconozco la concentración de las soluciones que uso a diario y cuál es su importancia?
ACTIVIDADES DE CLASE:
Evaluación de la pregunta problematizadora del primer período. Favor prepararse al respecto.
Organizados en grupos de dos estudiantes traer en lo posible empaques de sal, crema dental, talcos, jabón, decol, removedor, vino, esmalte, gaseosa, abono, entre otros. De igual manera traer dos pliegos de cartulina y marcadores.
Explicación del tema: Molalidad y Normalidad.
Desarrollo de ejercicios propuestos por la docente
ACTIVIDADES DE CLASE:
Revisión de la dilución del suero, apoyado en las operaciones matemáticas explicadas en la clase pasada.
Organizados en grupos de tres estudiantes llevar los ingredientes necesarios para preparar la bebida favorita del siguiente listado:
limonada, milo, chocolate, aguadepanela
Siguiendo las instrucciones de la docente, prepara la bebida en todas las unidades de concentración vistas en clase (%p/p, %p/v, %v/v, M, m) y dilución.
Organiza un informe que contenga: Portada, objetivos, Justificación, marco teórico, procedimiento, registro de datos, observaciones, conclusiones.
Luego comparte con tus compañeros la solución preparada.
Animo este es el examen final.
Revisión de los compromisos con los estudiantes que a la fecha presentan desempeño básico o bajo.
VALORACIÓN DIMENSIÓN FORMATIVA: Favor pegar al cuaderno o imprimirlo. Con juicio crítico realiza la autoevaluación
CRITERIO
|
AUTO
EVALUACION
|
COE
VALUACION
|
HETERO
EVALUACION
| |
1
|
Busco la excelencia en el desarrollo y presentación de tareas y trabajos.
| |||
2
|
Presento buena disposición en clase, soy atento y participativo.
| |||
3
|
Mantengo buena disciplina durante toda la clase.
| |||
4
|
Acato las normas de presentación personal establecidas por la Institución.
| |||
5
|
Cumplo oportunamente con las actividades extra clase.
| |||
TOTAL
|
Acciones de Mejora:
__________________________________________________________________________________________________________________________________________________
Acciones Correctivas:
__________________________________________________________________________________________________________________________________________________
__________________________________________________________________________________________________________________________________________________
Acciones Preventiva:
__________________________________________________________________________________________________________________________________________________
ACTIVIDADES DE CLASE:
Explicación de Molalidad y dilución
Llevar el suero preparado en la clase anterior.
Llevar el suero preparado en la clase anterior.
21 de marzo de 2018
ACTIVIDADES DE CLASE:Explicación de Molaridad- Molalidad.
Llevar por grupos de 4 estudiantes los siguientes materiales para preparar suero casero:
Pueden llevar la tablet o celular para consultar aspectos del suero indicados desde la clase.
Ingresar al siguiente link:
https://salud.uncomo.com/articulo/como-preparar-suero-oral-casero-18475.html
- 1 litro de agua hervida o filtrada.
- 2 cucharaditas de azúcar: Levar media libra
- 1 cucharaditas de sal: Llevar media libra
- 1 cucharadita de bicarbonato.: Llevar una bolsa pequeña
- zumo de limón: Llevar 100 cc.
- 1 botella litro plástica
- Un valde pequeño
14 de marzo de 2018
No se programan actividades, ya que se trabajará solo Biología.
7 de Marzo de 2018
Actividades de clase:
Revisión y calificación del proyecto de Investigación.
Explicación del tema: % V/V
Traer por favor el siguiente material: 1 Botella de alcohol, 3 vasos plásticos desechables.
Actividades de clase:
Dios permita que la seguridad en el Municipio del Espinal mejore.
21 de febrero
Actividades de clase:
Quiz de los temas vistos en la clase anterior. Favor estudiar.
Resolver las actividades pendientes de la semana pasada:
Resolver las actividades pendientes de la semana pasada:
Cada estudiante debe traer 1 libra de sal y 3 vasos plásticos desechables transparentes.
Nota: La preparación de la limonada y del milo la aplazamos para la siguiente clase.
Explicación del tema:
Nota: La preparación de la limonada y del milo la aplazamos para la siguiente clase.
Explicación del tema:
LAS SOLUCIONES
Las soluciones en química, son mezclas homogéneas de sustancias en iguales o distintos estados de agregación. La sustancia presente en mayor cantidad suele recibir el nombre de solvente, y a la de menor cantidad se le llama soluto y es la sustancia disuelta.
CLASES DE SOLUCIONES
Por la concentración del soluto y el solvente pueden ser:
Concentración: es la cantidad de soluto que hay en una cantidad dada de solvente o disolución. La relación entre las masas del soluto y el solvente permite establecer diferentes clases de soluciones. Se las puede clasificar según el siguiente esquema:
UNIDADES DE CONCENTRACIÓN
Unidades físicas:
Porcentaje por peso o porcentaje peso a peso (%P/P):
Indica el peso del soluto por cada 100unidades de peso de la solución.
Su fórmula es: %P/P = peso del soluto x 100%
Peso de la solución
Porcentaje por volumen o porcentaje volumen a volumen (%V/V):
Se utiliza cuando el soluto y el solvente son líquidos.
Su fórmula es: %V/V = volumen del soluto x 100
Volumen de la solución
Porcentaje peso a volumen (%P/V):
Indica el número de gramos de soluto que hay en cada 100ml de solución.
Su fórmula es:
%P/V = gramos del soluto x 100%
Mililitros de solución
Partes por millón (ppm):
Unidad que se refiere a las partes de soluto por cada millón departes de solución. Usualmente se expresan en Kg de solución que equivale a un millón de miligramos. Su fórmula es:
Ppm = miligramos de soluto
Litros de solución
Unidades Químicas de concentración
MOLARIDAD (M): Se define como el número de moles de soluto disueltos en un litro de solución. Matemáticamente se expresa así:
M: moles de soluto
Litros de solución
Molalidad (m) Indica la cantidad de moles de soluto presentes en un Kg. de solvente. Cuando el solvente de agua, y debido a que la densidad de esta es 1gr/ml, 1 Kg. de agua equivalente a un litro. La molalidad se calcula mediante la expresión:
M: moles de soluto
Kg de solvente
Normalidad (N) Relaciona el numeró de equivalentes gramos o equivalentes químicos de un soluto con la cantidad de solución, en litros. Se expresa como:
N: No. equivalentes-gr de soluto
Litros de solución
El concepto de equivalente gramo o equivalente químico ha sido desarrollado especialmente para referirse a ácidos y bases. Así, un equivalente –gramo es la masa de sustancia (acido _ase) capaz de reproducir un mol de iones H+ o OH- , según el caso.
Fracción Molar (X) Expresa el número de moles de un componente de la solución, en relación con el número total de moles, incluyendo todos los componentes presentes calcula mediante la expresión:
Fx: moles de A
Moles totales
Resolver los siguientes ejercicios:
14 de febrero
Queridos estudiantes, les deseo muchos éxitos en el presente año escolar 2018.
Recuerden y practiquen ....
ACTIVIDADES DE CLASE
1°Presentación y explicación de pautas de la clase y criterios de evaluación del área.
Encuadre pedagógico:
Cada inicio o finalización de clase se aplicará un quiz, sea oral o escrito, individual o grupal.
Las actividades extraclase que no se entreguen en la fecha, se recibirán en la siguiente clase, sustentando una de las preguntas de la actividad asignada.
Los talleres de clase se califican en clase.
Actividades grupales para la casa no están autorizadas.
Para opinar o participar es necesario solicitar la palabra
Habrá acción reparadora para aquellos estudiantes que ingresen sin ninguna justificación luego de iniciada la clase.
Es necesario respetar a los compañeros y docente
Todos deben contribuir con la disciplina
Todos deben contribuir con el aseo del aula de clase
En las evaluaciones se sumará 0.5 a la calificación obtenida, si se evidencia buena ortografía y caligrafía.
El blog debe visitarse cada sábado para enterarse de las actividades de clase y extraclase.
Cualquier inquietud, favor comunicarla solo a través del blog.
2°Presentación y organización de la lista de clase.
3° Entrega de temas, competencias del período y pregunta problematizadora:
GIMNASIO PEDAGÓGICO NOVA ESTRELLA
I Periodo
Química
Grado Noveno
Competencias:
Analiza las relaciones cuantitativas entre solutos y solventes, así como los factores que afectan la formación de soluciones.
Prepara soluciones y determina concentraciones.
Asumo los valores de: responsabilidad, equidad, tolerancia y respeto dentro y fuera del aula.
Conocimientos:
Soluciones
Orientador
Para que nuestros estudiantes, brillen por la inteligencia de su mente y de su corazón
PREGUNTA PROBLEMATIZADORA
Por qué es indispensable conocer los componentes y la concentración de una solución?
PROYECTO DE INVESTIGACIÓN: Para ser entregado y socializado el 7 de marzo.
Por qué son importantes las soluciones para el bienestar ambiental, la salud humana y el desarrollo industrial?
Para ello debes consultar mínimo dos ejemplos de soluciones que contribuyan al bienestar ambiental, la salud humana y el desarrollo industrial.
A cada ejemplo solicitado, favor consultar su composición, estado de agregación y sus propiedades físicas y químicas.
De igual manera dibujar los ejemplos de las sustancias antes mencionadas y elaborar carteles didácticos que contengan dicha información.
Organizar estas ideas en un informe escrito.
Resolver las siguientes preguntas de inducción al tema:
¿Qué es una disolución?
Para facilitarte la respuesta, realiza esta entretenida experiencia:
· Mezcla en un recipiente un poco de agua y un poco de arena. Agita bien y anota tus observaciones.
· Mezcla en otro recipiente agua y un poco de azúcar, agita. Compara tus observaciones con las del punto 1. ¿Hay diferencias? Enuméralas.
· Analiza: ¿Qué método utilizaría para separar los componentes de las mezclas 1 y 2?
· Consulta en tu diccionario los términos homogéneo y heterogéneo. Cuál de las dos mezclas es homogénea?, ¿Cuál aes heterogénea?
· Las disoluciones son mezclas homogéneas de dos o más sustancias. Según esto, ¿Cuál de las dos mezclas anteriores es una disolución?
· El latón es una aleación de cobre y zinc; el bronce es una aleación de cobre, zinc y estaño, de acuerdo con esto que entiendes por aleación? Es correcto afirmar que las aleaciones son disoluciones? Por qué? Para qué sirven las aleaciones?
· El aire que respiras es una mezcla de nitrógeno, oxígeno y otros gases, Se puede afirmar que el aire es una disolución? ¿Por qué?
· Las disoluciones líquidas son las más conocidas. Escribe dos ejemplos de ellas.
· Observa a tu alrededor e identifica ejemplos de disoluciones sólidas y gaseosas.
· Las disoluciones son un estado intermedio entre mezclas y combinaciones. Define con tus palabras mezcla, combinación y disolución. Escribe ejemplos de cada una.
Explicación del tema:
LAS SOLUCIONES
Las
soluciones en química, son mezclas homogéneas de sustancias en iguales o
distintos estados de agregación. La sustancia presente en mayor cantidad suele
recibir el nombre de solvente, y a la de menor cantidad se le llama soluto y es
la sustancia disuelta.
CLASES DE SOLUCIONES
Por
la concentración del soluto y el solvente pueden ser:
Concentración:
es la cantidad de soluto que hay en una cantidad dada de solvente o disolución.
La relación entre las masas del soluto y el solvente permite establecer
diferentes clases de soluciones. Se las puede clasificar según el siguiente
esquema:
UNIDADES DE CONCENTRACIÓN
Unidades físicas:
Porcentaje
por peso o porcentaje peso a peso (%P/P):
Indica
el peso del soluto por cada 100unidades de peso de la solución.
Su
fórmula es: %P/P = peso del soluto x
100%
Peso de la
solución
Porcentaje
por volumen o porcentaje volumen a volumen (%V/V):
Se
utiliza cuando el soluto y el solvente son líquidos.
Su
fórmula es: %V/V = volumen del soluto x 100
Volumen de la
solución
Porcentaje
peso a volumen (%P/V):
Indica
el número de gramos de soluto que hay en cada 100ml de solución.
Su
fórmula es:
%P/V
= gramos del soluto x 100%
Mililitros de solución
Partes
por millón (ppm):
Unidad
que se refiere a las partes de soluto por cada millón departes de solución.
Usualmente se expresan en Kg de solución que equivale a un millón de
miligramos. Su fórmula es:
Ppm
= miligramos de soluto
Litros de solución
Unidades Químicas de concentración
MOLARIDAD
(M): Se define como el número de moles de soluto disueltos en un litro de
solución. Matemáticamente se expresa así:
M: moles
de soluto
Litros de solución
Molalidad
(m) Indica la cantidad de moles de soluto presentes en un Kg. de solvente.
Cuando el solvente de agua, y debido a que la densidad de esta es 1gr/ml, 1 Kg.
de agua equivalente a un litro. La molalidad se calcula mediante la expresión:
M: moles
de soluto
Kg de
solvente
Normalidad
(N) Relaciona el numeró de equivalentes gramos o equivalentes químicos de un
soluto con la cantidad de solución, en litros. Se expresa como:
N: No.
equivalentes-gr de soluto
Litros de solución
El
concepto de equivalente gramo o equivalente químico ha sido desarrollado
especialmente para referirse a ácidos y bases. Así, un equivalente –gramo es la
masa de sustancia (acido _ase) capaz de reproducir un mol de iones H+ o OH- ,
según el caso.
Fracción
Molar (X) Expresa el número de moles de un componente de la solución, en
relación con el número total de moles, incluyendo todos los componentes
presentes calcula mediante la expresión:
Fx: moles
de A
Moles totales
Resolver los siguientes ejercicios:








No hay comentarios:
Publicar un comentario